Por: Héctor R. Eliosa León, Adriana Berenice Silva Gómez
Ver en el PDF
En los animales, los órganos de los sentidos (vista, olfato, gusto, tacto y oído) son relevantes porque les permiten obtener información de su entorno, desde cualidades físicas y químicas propias del medio ambiente, hasta las generadas por otros seres vivos que coexisten con ellos. La importancia que cada sentido tiene en la sobrevivencia de los animales varía de un grupo a otro, lo cual está relacionado estrechamente con sus hábitos de vida. Por otra parte, la acumulación de conocimientos generados por diversas disciplinas biológicas indica que los órganos de los sentidos no surgieron simultáneamente en los vertebrados; es decir, unos aparecieron primero y otros después en la historia evolutiva de este grupo. No obstante, el sistema nervioso mantiene el control del funcionamiento de todos los órganos de los sentidos, sin importar las diferencias en la complejidad estructural que puedan existir en cada grupo animal. En el caso del olfato, se trata muy probablemente del más antiguo de los sentidos y su función ha resultado muy útil en el mantenimiento de cada linaje (Hoover, 2010).
Este sentido brinda información a los organismos a partir de la detección de sustancias químicas denominadas moléculas odoríferas, que pueden producirse desde una fuente distante de los organismos que las perciben. Las moléculas odoríferas terrestres son muy volátiles, vaporizan fácilmente y están representadas por una gran variedad de partículas que incluyen aceites, alcoholes, aminoácidos, ésteres y ácidos; mientras que, en un ambiente acuático, esas moléculas son solubles en agua. Es sorprendente que, a pesar de la gran diversidad de moléculas odoríferas, todas ellas son similares en tamaño, forma, peso y organización geométrica; y todas ellas, al unirse a los receptores olfativos, inician los procesos de neurotransmisión de la información detectada. Como resultado de la percepción de los olores, los animales pueden reconocer presas, detectar depredadores, buscar alimentos, buscar pareja y reconocer rutas de migración. Además, el olfato puede invitar a un organismo, o persuadirlo de acercarse a la fuente de olor; por ejemplo, el olor desagradable de la putrefacción de cadáver aleja a muchos animales que no se alimentan de carroña.
EL OLFATO EN LOS VERTEBRADOS
El sistema olfatorio en los vertebrados está formado, de manera general, por el epitelio olfatorio, el bulbo olfatorio principal y el bulbo olfatorio accesorio que envían la información odorífera detectada en el ambiente hacia la corteza cerebral para que el organismo responda de manera eficiente al estímulo ambiental.
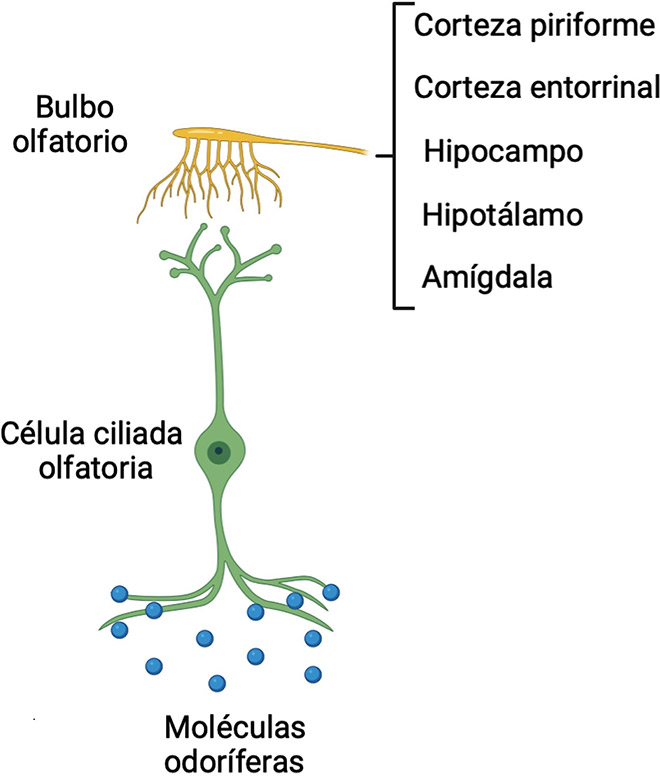
El epitelio olfatorio se encuentra en la cavidad nasal (Papes, 2018), consta de neuronas bipolares que establecen contacto, por un lado, con el medio en el cual se encuentran las moléculas odoríferas, y por el otro, con el sistema nervioso central a través del bulbo olfatorio principal. Las dendritas de las neuronas olfatorias están cubiertas por cilios o microvellosidadades de las cuales se presume que son el sitio en donde se lleva a cabo la transducción olfatoria, es decir, el lugar donde el mensaje químico es convertido en impulsos eléctricos debido al hecho de que las moléculas odoríferas establecen el complejo ligando-receptor con los receptores de membrana acoplados a proteínas G que, a su vez, activan las vías de señalización intracelular (Eisthen, 2002).
Una vez establecido el complejo ligando-receptor, se inicia la transmisión de los impulsos nerviosos desde la neurona olfatoria hacia el bulbo olfatorio principal (ver Figura 1; Hoover, 2010), que es una estructura que contiene miles de módulos de conectividad neuronal denominados glomérulos. Estas estructuras son neuropilos esféricos grandes dentro de los cuales los axones de las neuronas olfatorias establecen contactos sinápticos excitatorios sobre las dendritas de las células mitrales y las células en penacho (Mori et al., 1999) para enviar la información a la corteza piriforme. Adicionalmente, la información es procesada en la amígdala, en el hipocampo y en la corteza entorrinal (Purves et al., 2007), lo que promueve que un organismo reaccione ante un olor con una emoción, y la posibilidad de generar memoria del estímulo olfativo. Así, los mamíferos pueden reaccionar ante un olor antes de pensar en su efecto (Hoover, 2010).
Las feromonas, definidas rigurosamente como señales químicas intraespecíficas que comunican información mutuamente benéfica sobre el estado de un individuo para provocar una reacción en otro, son detectadas por el órgano vomeronasal que envía la información a través de sus axones a las células mitrales del bulbo olfatorio accesorio y, finalmente, a las cortezas y núcleos involucrados en este sistema sensitivo (Hovis et al., 2012). Existen varios tipos de feromonas: las primarias, las informativas, las moduladoras y las liberadoras. Las feromonas primarias están asociadas con la fisiología endocrina y reproductiva, mientras que las feromonas informativas solo tienen como objetivo comunicar información sobre el estado que guarda el individuo. Las feromonas moduladoras son usadas para provocar cambios en el estado de ánimo y emociones de otro individuo. Finalmente, las feromonas liberadoras son señales que se generan para producir una respuesta conductual inmediata asociada con la atracción sexual (Hoover, 2010).
UNA POSIBLE RUTA EVOLUTIVA DEL SISTEMA OLFATORIO EN VERTEBRADOS
Además de los vertebrados, el olfato también está presente en algunos animales invertebrados como los nematodos, moluscos, crustáceos e insectos; llama la atención de los biólogos la similitud básica en la organización de los sistemas olfativos de todos estos animales. ¿Cuál es la causa subyacente de esta similitud? Desde el punto de vista evolutivo, al considerar la relación filogenética de los grupos referidos arriba con los vertebrados, la similitud no se debe a una herencia compartida a partir de ancestros remotos sino a una convergencia evolutiva, es decir, que cada grupo animal adquirió de manera independiente la organización del olfato como respuesta a condiciones ambientales similares (Eisthen, 2002). En el caso de los vertebrados, se observa una mayor complejidad tanto estructural como funcional, además de que los genes que codifican para los receptores de los olores muestran una evolución dinámica, por lo que resulta interesante entender cómo se fue diferenciando este sentido en las distintas clases del grupo, especialmente si se considera que, durante el transcurso de la evolución de los vertebrados, diferentes estructuras del sistema nervioso relacionadas con el olfato han incrementado su tamaño de manera diferencial; por ejemplo, el olfato juega el papel principal en el desarrollo del sistema nervioso de los mamíferos (Taniguchi y Taniguchi, 2014), pero no en otras clases.
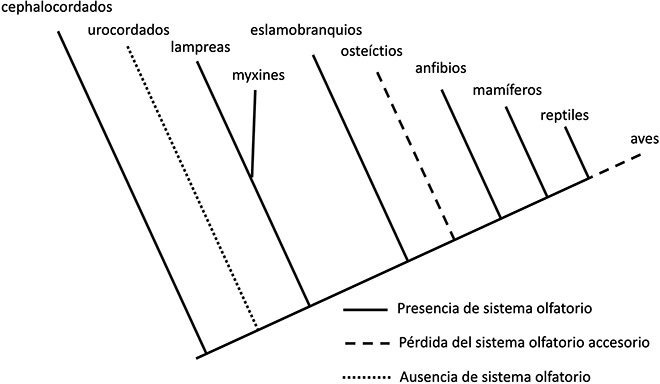
Para tener un panorama completo del desarrollo del olfato en los vertebrados, es necesario considerar la información que nos brinda la filogenia y un estudio comparativo de las características morfológicas y funcionales del olfato de los grupos del filo de los cordados. Estos animales reciben su nombre debido a que, entre otras características, en la etapa temprana de su ciclo de vida presentan una estructura de sostén corporal denominada notocorda, la cual en los vertebrados es sustituida en etapas posteriores de su desarrollo por la columna vertebral. En los cordados también se incluye a los urocordados y a los cefalocordados, animales marinos que presentan notocorda, pero no desarrollan columna vertebral y, por lo tanto, son parientes cercanos de los vertebrados.
En la actualidad aún existe controversia sobre el grupo que resulta hermano de los vertebrados, es decir, sobre cuál está más estrechamente relacionado con ellos desde el punto de vista evolutivo; sin embargo, recientemente se acepta que los urocordados son los animales más cercanos a los vertebrados, por lo que los cefalocordados son considerados los cordados ancestrales (Satoh et al., 2014). Para facilitar el entendimiento de la evolución de los cordados se muestra su filogenia simplificada en la Figura 2. Los cefalocordados son animales marinos de forma pisciforme, conocidos comúnmente como anfioxos, carecen de algún aparato olfatorio distintivo, pero a partir de la secuencia del genoma de estos animales se ha detectado la expresión de más de 30 genes de receptores olfativos (OR, por sus siglas en inglés) en neuronas bipolares del epitelio rostral de los anfioxos adultos, lo que significa que son capaces de realizar una función olfatoria detectando partículas odoríferas solubles en agua; de acuerdo con esto, se puede considerar que estos genes y sus asociados son evolutivamente los más ancestrales de los cordados. Por otra parte, los urocordados, al igual que los anfioxos, son animales marinos, pero han desarrollado una mayor diversidad: los hay bentónicos sésiles en su fase adulta, como las ascidias (o patatas de mar), y pelágicas como los taliáceos y larváceos. En los tres tipos de urocordados el sistema nervioso es muy reducido y los receptores sensoriales están pobremente desarrollados y hasta el momento no se han registrado genes relacionados con la función olfativa en estos animales, por lo que filogenéticamente se trataría de una reversión evolutiva, es decir, de la pérdida en estos animales de la característica olfativa ya presente en el ancestro del grupo. Si estudios futuros en los urocordados demuestran la existencia de genes ligados al olfato, se debe descartar la afirmación anterior. Los vertebrados se originaron en el periodo Ordovícico inferior (470 millones de años), y sus parientes más próximos (urocordados y cefalocordados) están presentes en sedimentos ligeramente más antiguos, es decir, del periodo Cámbrico (Janvier, 2015).
Los fósiles de algunos de los primeros vertebrados, conocidos como ostracodermos (peces sin mandíbula), indican que tuvieron una diversificación temprana en la que unos grupos presentaban un solo orificio nasal, como sus descendientes contemporáneos (lampreas y myxines) y otros grupos presentaban dos orificios nasales; por el momento, se desconoce la condición inicial respecto al número de orificios nasales. Sin embargo, considerando que las lampreas y los myxines representan actualmente las condiciones más cercanas a los primeros vertebrados, se puede señalar que esos primeros organismos presentaban un órgano olfatorio periférico consistente en el epitelio sensorial olfativo del único orificio nasal, el cual proyecta al bulbo olfatorio principal (MOB, por sus siglas en inglés), y un órgano accesorio que envía información al MOB separadamente del epitelio olfativo. Esto sugiere que, desde los primeros vertebrados, se inició la diferenciación del olfato en dos sistemas complementarios. En los condrictios (tiburones, rayas y quimeras), la evidencia reciente indica que poseen también un sistema olfativo dual, esto es, uno bien desarrollado consistente en un epitelio olfatorio formado por numerosas lamelas primarias y neuronas receptoras localizadas en las narinas (cavidades no comunicadas con la boca), las cuales proyectan al MOB que las controla; y otro incipiente, relacionado con el bulbo olfatorio accesorio (AOB por sus siglas en inglés), por lo que su capacidad olfativa es diversa y eficiente. Además, presentan dos orificios nasales.
En los osteíctios (peces óseos), el grupo más diverso de los vertebrados, también se presentan dos orificios nasales y se conserva únicamente el sistema olfativo principal en la mayoría de sus integrantes, por lo que habría ocurrido una reversión evolutiva del sistema olfativo accesorio. A pesar de esta condición, es decir, de la permanencia del sistema olfatorio principal, existe gran variación en la capacidad olfativa de los peces ya que algunos, como las anguilas depredadoras, detectan olores muy diluidos en contraste con la pobre agudeza olfativa de los lucios, lo que significa que los genes de los receptores olfativos tienen una amplia variación, ya que se han reconocido ocho de los nueve linajes de genes olfativos.
Sin embargo, en los peces relacionados con el grupo ancestral de los anfibios, denominados sarcopterigios, se mantuvieron los dos sistemas olfativos, aunque el accesorio seguía teniendo poca importancia. La filogenia de los vertebrados indica que durante la evolución se produjo una subdivisión anatómica y funcional temprana de los sistemas químicos nasales, sobre todo de los sistemas olfatorios y vomeronasales, que incluyen diferentes receptores y áreas de proyección primaria y secundaria. Los diferentes sistemas químicos han sufrido involución diferencial en ciertos taxones debido a presiones evolutivas (Ubeda-Bañon et al., 2011).
Desde el origen de los cordados en el Cámbrico, hasta el origen de los anfibios en el periodo Devónico, transcurrieron aproximadamente 150 millones de años en los que la totalidad de los vertebrados habitaba ambientes acuáticos, lo que significa que el olfato detectaba únicamente las partículas disueltas en agua. Es en los anfibios (ranas, sapos, salamandras), primeros vertebrados terrestres originados en el Devónico medio en quienes se reconoce bien desarrollado el sistema olfativo accesorio, además del principal, pudo ser una adaptación diferencial a los nuevos desafíos de la variación ambiental, quizá debido a que las partículas odoríferas viajan más rápido en el aire que en el agua. El sistema olfatorio accesorio de los tetrápodos, conocido como órgano vomeronasal u órgano de Jacobson, evolutivamente se desarrolla a partir de la diferenciación del epitelio olfatorio primitivo de los peces. En los anfibios se localiza en la base del septo nasal, donde se alojan las neuronas sensoriales vomeronasales, las cuales envían información al AOB. La función de este sistema está relacionada con la captura de información proveniente de las feromonas. En estos animales, el sistema olfatorio principal es responsable de la captación de las moléculas odoríferas (no feromonas). De esta manera, a los anfibios, los dos sistemas olfatorios les brindan la oportunidad de tener un mejor reconocimiento de lo que ocurre en su entorno, ya sea acuático o terrestre. En la rana Xenopus tropicalis se han registrado 824 genes funcionales OR, cantidad significativamente mayor a la registrada en los peces debido a que retiene genes que pueden reconocer olores tanto dentro como fuera del agua.
En los reptiles, el sistema olfatorio principal se conserva con cambios mínimos, pero el sistema olfatorio accesorio presenta modificaciones o desaparece en algunos grupos. Los mayores cambios ocurren en los escamados (serpientes y lagartijas). El órgano de Jacobson en las serpientes alcanza el mayor desarrollo entre los vertebrados, está aislado de la cavidad nasal y abre en la cavidad oral mediante un conducto anterior al que llegan las partículas transportadas por la lengua, las cuales alcanzan el epitelio vomeronasal, iniciando así la ruta informativa que se proyecta al AOB. En tortugas, el órgano vomeronasal está pobremente desarrollado, y en los cocodrilos no se presenta.
En las aves, el sistema olfatorio consiste en el sistema olfatorio principal únicamente, poque el sistema olfatorio accesorio no existe; sin embargo, se ha observado que tienen de 100 a 700 genes OR, con lo que suple dicha carencia. Hasta aquí se puede señalar que, considerando la estrecha relación de parentesco existente entre cocodrilos y aves, en el ancestro común de ambos grupos ocurrió una reversión evolutiva respecto al órgano vomeronasal, y que los descendientes heredaron esa condición.
Los mamíferos conservan los dos sistemas olfatorios en la mayoría de sus integrantes, pero cetáceos (ballenas y delfines), manatís y algunos primates carecen del sistema olfatorio accesorio.
En la mayoría de los mamíferos se da una repartición de funciones olfativas similar a la que ocurre en otros tetrápodos, ya que el sistema olfatorio principal capta partículas odoríferas y el órgano vomeronasal detecta las feromonas, lo cual se hace evidente por la presencia de un mayor número de genes OR que puede llegar hasta 1,207, como ocurre en algunos roedores, por lo que el olfato se considera un sentido muy desarrollado y eficiente en estos animales.
Existe controversia entre los especialistas respecto al origen y función del sistema olfatorio accesorio; sin embargo, ahora se piensa que un sistema olfatorio dual apareció en los primeros vertebrados, debido a que recientemente se ha descubierto en las lampreas la presencia de epitelio olfatorio principal y epitelio vomeronasal (Chang et al., 2013). Además, resulta extraordinaria la semejanza en la ruta vomeronasal de los tetrápodos con la ruta del olfato accesorio de las lampreas. También se ha descubierto que el órgano olfativo accesorio tiene conexiones con el sistema olfativo principal, el bulbo olfatorio, el neuropilo telencefálico dorsomedial (DTN, por sus siglas en inglés) y la palia e, indirectamente, con el hipotálamo rostral.
Por lo tanto, el epitelio olfatorio accesorio (AOE, por sus siglas en inglés) de la lamprea expresa todas las familias conocidas de genes quimiorreceptores de lamprea. Desde su descubrimiento por Scott, en 1887, se ha sugerido que el AOE de Petromyzon funciona como órgano de Jacobson. Sin embargo, a nivel del circuito neuronal, así como en el nivel molecular, parece que el sistema dual de la lamprea no está tan segregado como el sistema olfatorio dual de los tetrápodos. Con respecto a la funcionalidad del AOB en los vertebrados, se puede sugerir que el órgano vomeronasal no se originó para capturar las partículas presentes en el aire, sino para ampliar la gama de odorantes percibidos por los tetrápodos. Asimismo, el sistema olfativo secundario tiene importancia diferencial y funciones diferentes en los vertebrados, ya que parece que las conductas de forrajeo y reproducción de los reptiles están en relación con el sistema vomeronasal, en tanto que en los mamíferos está involucrado en la recepción de feromonas.
CONCLUSIÓN
El sistema olfatorio brinda información relevante a los vertebrados a partir de los olores, pero no tiene la misma importancia en todos ellos, ni siquiera dentro del mismo grupo, lo cual está relacionado con la complejidad estructural y funcional del sistema olfatorio y con la forma de vida de cada clase de vertebrado. En los peces prevalece el MOB como centro controlador del olfato, en tanto que, en los tetrápodos, de manera general, el MOB y el AOB funcionan simultáneamente.
Finalmente, no se debe olvidar que la función olfativa es mediada por el sistema nervioso y, como consecuencia, la información obtenida de esta manera por los organismos va más allá de los bulbos olfatorios; así, a través de los olores, los vertebrados pueden generar una “memoria del olor” que les permite responder adecuadamente a las presiones selectivas; por ejemplo, entre los peces, el salmón debe regresar a los ríos donde fue engendrado para a su vez reproducirse y perpetuar su linaje, actividad que no podría realizar si no fuera por la “memoria del olor”, es decir, la capacidad que tienen estos peces para percibir los olores que registraron en las primeras etapas de su desarrollo.
REFERENCIAS
Chang S, Chung-Davidson YW, Libants SV, Nanlohy KB, Kiupel M. Brown CT and Li W (2013). The sea lamprey has a primordial accessory olfactory system. BMC Evolutionary Biology 13:172.
Eisthen HL (2002). Why are olfactory systems of different animals so similar? Brain, Behavior and Evolution 29: 273-293.
Hoover KC (2010). Smell with inspiration: The evolutionary significance of olfaction. American Journal of Physical Anthropology 143 (Suppl 51): 63-74. doi:10.1002/ajpa.21441.
Hovis KR, Ramnath R, Dahlen JE, Romanova AL, LaRocca G, Bier ME and Urban NN (2012). Activity regulates functional connectivity from the vomeronasal organ to the accessory olfactory bulb. The Journal of Neuroscience 32(23): 7907-7916.
Janvier P (2015). Facts and fancies about early fossil chordates and vertebrates. Nature 520:483-489
Mori K, Nagao H and Yoshihara Y (1999). The olfactory bulb: coding and processing of odor molecule information. Science 286: 711-715.
Papes F, Nakahara TS and Camargo AP (2018). Behavioral Assays in the Study of Olfaction: A Practical Guide. Methods in Molecular Biology 1820:289-388. doi:10.1007/978-1-4939-8609-5_21.
Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, Mcnamara JO y Williams SM (2007). Sentidos químicos. En Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, Mcnamara JO y Williams SM (Eds.), Neurociencia (pp 370-389). Editorial Médica Panaméricana. España.
Satoh N, Rokhsar D and Nishikawa T (2014). Chordate evolution and the three-phylum system. Proceedings of the Royal Society B: Biological Science 281:1-10.
Taniguchi K, and Taniguchi K (2014). Phylogenic Studies on the Olfactory System in Vertebrates. The Journal of Veterinary Medical Science 76(6): 781-788.
Ubeda-Bañon I, Pro-Sistiaga P, Mohedano-Moriano A, Saiz-Sanchez D, de la Rosa-Prieto C, Gutierrez-Castellanos N, Lanuza E, Martinez-Garcia F and Martinez-Marcos A (2011). Cladistic analysis of the olfatory and vomeronasal systems. Frontiers in Neuroanatomy 5:3 doi: 10.3389/fnana.2011.00003.